Bảng tuần hoàn hóa học rõ nét và quy tắc thành lập
Bảng tuần hoàn hóa học chính xác và rõ nét nhất 2022! Mời các bạn cùng xem và tham khảo.
1. Bảng tuần hoàn hóa học rõ rét
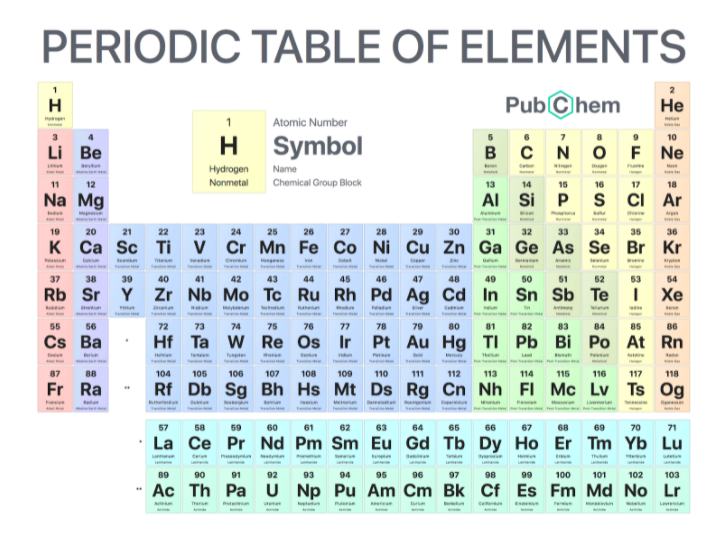
Bảng tuần hoàn hóa học
Bảng tuần hoàn hóa học hay còn gọi là bảng tuần hoàn các nguyên tố hóa học hiển thị tên, kí hiệu, cấu hình electron, số oxi hóa và phân loại tính chất hóa học của chúng.ầ
Các nguyên tố trong bảng được sắp xếp theo thứ tự tăng dần của số hiệu nguyên tử, các nhóm hóa trị và tính chất hóa học theo độ mạnh hoặc yếu tăng dần.
Bảng tuần hoàn hóa học được sử dụng rộng rãi trong hóa học , vật lý và các ngành khoa học khác, và thường được xem như một biểu tượng của hóa học.
2. Quy tắc thành lập bảng tuần hoàn
Bảng được chia thành bốn khu vực gần như hình chữ nhật được gọi là khối. Các hàng của bảng được gọi là chu kỳ và các cột được gọi là nhóm. Các nguyên tố thuộc cùng một nhóm cột của bảng tuần hoàn có đặc điểm hóa học tương tự nhau.

Bảng tuần hoàn hóa học quy tắc thành lập
Chu kỳ
Bảng tuần hoàn các nguyên tố chứa tất cả các nguyên tố hóa học đã được phát hiện hoặc chế tạo, chúng được sắp xếp theo thứ tự số nguyên tử của chúng trong bảy chu kỳ ngang.
Đầu tiên là chu kỳ hydro, bao gồm hai nguyên tố hydro và helium. Sau đó, có hai chu kỳ của mỗi tám nguyên tố: chu kỳ ngắn đầu tiên từ liti đến neon và chu kỳ ngắn thứ hai từ natri đến argon.
Có hai chu kỳ gồm 18 nguyên tố, mỗi chu kỳ: chu kỳ dài đầu tiên từ kali đến krypton; và chu kỳ dài thứ hai từ rubidi đến xenon.
Chu kỳ thứ nhất dài 32 nguyên tố, từ xêzi đến radon được xếp thành 18 cột do bỏ qua các nguyên tố họ lanta. 18 nguyên tố họ lanta, có tính chất gần giống với các nguyên tố tương ứng của thời kỳ dài thứ nhất và thứ hai, được xếp thành 2 hàng dưới cùng tách riêng khỏi các hàng trên.
Chu kỳ dài 32 nguyên tố thứ hai từ franxi đến oganesson cũng được xếp thành 18 cột bằng cách bỏ qua các chất hoạt hóa.

Quy tắc sắp xếp bảng tuần hoàn
Nhóm
Sáu khí quý — helium, neon, argon, krypton, xenon, và radon — xuất hiện ở cuối sáu chu kỳ hoàn thành và tạo thành nhóm Nhóm 18 (0) của hệ thống tuần hoàn.
Bảy nguyên tố từ liti đến flo và bảy nguyên tố tương ứng từ natri đến clo được xếp vào bảy nhóm: 1 (Ia), 2 (IIa), 13 (IIIa), 14 (IVa), 15 (Va), 16 (VIa) , và 17 (VIIa) tương ứng.
17 nguyên tố của chu kỳ thứ tư từ kali đến brom có những khác biệt về tính chất của chúng và được coi là cấu thành Nhóm 1–17 (Ia – VIIa) của hệ thống tuần hoàn.

Tính chất hóa học của các nhóm nguyên tố
Xu hướng thay đổi các tính chất hóa học
Tính tuần hoàn trong tính chất của các nguyên tố được sắp xếp theo số hiệu nguyên tử được thể hiện rõ nét qua việc xem xét trạng thái vật lý của các chất cơ bản và các tính chất liên quan như điểm nóng chảy, khối lượng riêng và độ cứng.
Các nguyên tố thuộc Nhóm 18 (0) là những chất khí khó ngưng tụ. Các kim loại kiềm, trong Nhóm 1 (Ia), là chất rắn kim loại mềm có nhiệt độ nóng chảy thấp.
Các kim loại kiềm thổ, trong Nhóm 2 (IIa), cứng hơn và có nhiệt độ nóng chảy cao hơn các kim loại bên cạnh các kim loại kiềm. Độ cứng và điểm nóng chảy tiếp tục tăng qua các Nhóm 13 (IIIa) và 14 (IVa) và sau đó giảm dần qua các Nhóm 15 (Va), 16 (VIa) và 17 (VIIa).
Các nguyên tố ở thời kỳ dài cho thấy độ cứng và nhiệt độ nóng chảy tăng dần từ kim loại kiềm ban đầu đến gần trung tâm của chu kỳ và sau đó ở Nhóm 16 (VIa) giảm dần đối với các halogen và khí quý.
Trên đây là bảng tuần hoàn hóa học mới nhất 2022 mà studytienganh giới thiệu đến các bạn.
Hẹn gặp lại các bạn trong những bài viết tiếp theo của studytienganh!